Permeabilitás [1]
Permeabilitás, vagy penetráció alatt azt a folyamatot értjük, amikor a molekula a vizes, apikális térből a membránon át a szintén vizes, bazolaterális térbe jut. A gyógyszerek membránon történő penetrációja az alábbi mechanizmusokkal mehet végbe (1. ábra):
- passzív (transzcelluláris) transzport (A)
- paracelluláris transzport (B)
- endocitózis (C)
- aktív transzport (influx/efflux – D,E)
- metabolikus folyamatok (F)
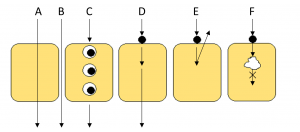
paracelluláris transzport; (C) endocitózis; (D) influx, (E) efflux, (F) metabolikus folyamatok
A passzív transzport a membrán apikális és bazolaterális oldala között kialakuló koncentrációgradiens hatására megy végbe. A paracelluláris transzport a passzív transzport egy formája, amely a sejtek közötti ún. szoros sejtkapcsolatokon keresztül valósul meg. A nagyobb méretű, lipofil molekulák endocitózissal juthatnak át a membránon, melyet a membránból lefűződő vezikulák segítenek. Aktív transzport a membránban lévő transzportfehérjék segítségével valósulhat meg, koncentráció gradienstől függetlenül, energia-befektetéssel. Két típusa az influx (bazolaterális oldal felé irányuló), és az efflux (apikális oldal felé irányuló) transzport. Egy gyógyszer esetében értelemszerűen az efflux transzporterekkel (pl. P-gp, MRP2) való kölcsönhatást lehetőleg minimalizálni kell. Metabolikus folyamatok is végbemehetnek a hatóanyagok membránon keresztül történő áthaladása során, ami elsősorban a bél epitéliumban is jelenlévő citokróm P450 izoenzimekkel hozható összefüggésbe.
A per os adagolt gyógyszerek 95%-ára a passzív transzport jellemző. Ennek oka főleg a magas lokális koncentráció miatti transzporter-telítődés, amely az aktív transzportnak szab gátat. Ezen kívül a passzív transzportot segítheti a vérben jelenlévő szérum albumin, amely a gyógyszer megkötésével csökkenti a szabad gyógyszerforma koncentrációját a bazolaterális oldalon, így fenntartja a koncentrációgradienst. A paracelluláris transzport a gyógyszerek kevesebb, mint 5%-ára jellemző , főként a kisméretű (<200 Da), hidrofil molekulák esetében releváns. [2]
PAMPA
A PAMPA (Parallel Artificial Membrane Permeability Assay) egy in vitro, sejtmembránokon történő felszívódás vizsgálatára alkalmas nem sejtes modell, melynek segítségével csak a passzív transzport modellezhető. A modellt Kansy és mtsai alkalmaztak először 1998–ban. [3] A PAMPA két egymásba illeszkedő 96 lyukú mérőtálcát (plate) alkalmaz, ahol a felső plate a membrán apikális, donor oldalát, az alsó pedig a membrán bazolaterális, akceptor oldalát modellezi.
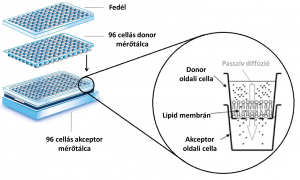
A biológiai membrán foszfolipid-összetételének megfelelő, n-dodekános oldatot a donor plate alján lévő polivinilidén-fluorid (PVDF) szűrőrétegre viszik fel, mely így a membrán szerepét tölti be. A donor oldalra általában a gyógyszervegyületek 100-500 μM-os oldata kerül, a modellezni kívánt kompartmentnek (gyomorsav, bél lumen stb.) megfelelő pH-jú pufferben oldva. Az akceptor oldalra általában a vérnek, vagy intersticiális folyadéknak megfelelő pH-jú puffert viszik fel, majd a tálcákat szendvics-szerűen egymásba helyezik, és egy megnedvesített szűrőpapírral letakarják a párolgási veszteség csökkentése érdekében. A rendszert ezután műanyag fedőlappal lezárják, és megfelelő ideig, fiziológiás hőmérsékleten (37 °C) inkubálják. Ezt követően a plate-eket szétszedik, és alkalmas analitikai módszerrel (UV spektrofotométer, HPLC/UV/MS) határozzák meg a gyógyszer-koncentrációt mind az akceptor, mind a donor oldali cellákban (well). A koncentráció-értékek felhasználásával megadható az effektív permeabilitás.
Szövetspecifikus modellek
A PAMPA modell előnyei közé sorolható nagy áteresztőképessége és robusztussága, ami miatt a gyógyszerkutatás korai fázisát támogathatja például gyógyszerjelölt hatóanyagok bélfelszívódásának előrejelzésével. A PAMPA membránjának lipidösszetétele, valamint a donor és fogadóoldali pH változtatható – ennek köszönhetően pedig különböző szövetspecifikus modellek alakíthatók ki. Kutatócsoportunk ezen területen már számos publikációval rendelkezik. Jelenleg a következő szöveteken való felszívódást vagyunk képes előrejelezni:
- bélepitélium (GI-PAMPA)
- bőr (skin-PAMPA; [4])
- bukkális nyálkahártya ([5])
- vér-agy-gát (BBB-PAMPA; [6])
- szaruhártya (cornea-PAMPA; [7])
Források
[1] Gy. T. Balogh, “Permeabilitás – PAMPA és Caco2 modellek,” in A gyógyszerkutatás kémiája, Gy. M. Keserű, Ed. Budapest: Akadémiai Kiadó, 2011, 355-356.
[2]G. Szeleczky, “Az ADME-tulajdonságokat befolyásoló biológiai tényezők,” in A gyógyszerkutatás kémiája, Gy. M. Keserű, Ed. Akadémiai Kiadó, 2011, 425-428.
[3] M. Kansy, F. Senner, and K. Gubernator, “Physicochemical high throughput screening: Parallel artificial membrane permeation assay in the description of passive absorption processes,” J. Med. Chem., 41, (7), 1007–1010, 1998.
[4] B. Sinkó, T. M. Garrigues, Gy. T. Balogh, Z. K. Nagy, O. Tsinman, A. Avdeef, and K. Takács-Novák, “Skin-PAMPA: A new method for fast prediction of skin penetration,” Eur. J. Pharm. Sci., 45, (5), 698–707, Apr. 2012.
[5] E. E. Borbás, A. Balogh, K. Bocz, J. Müller, É. Kiserdei, T. Vigh, B. Sinkó, A. Marosi, A. Halász, Z. Dohányos, L. Szente, Gy. T. Balogh, and Z. K. Nagy, “In vitro dissolution-permeation evaluation of an electrospun cyclodextrin-based formulation of aripiprazole using µFlux,” Int. J. Pharm., 491, (1–2), 180–189, Aug. 2015.
[6] Á. Könczöl, J. Müller, E. Földes, Z. Béni, K. Végh, Á. Kéry, and Gy. T. Balogh, “Applicability of a Blood-Brain-Barrier Specific Artificial Membrane Permeability Assay at the Earlier Stage of Natural Product-Based CNS Drug Discovery,” J. Nat. Prod., 76, 655-663., 2013.
[7] G. Dargó, A. Vincze, J. Müller, H. J. Kiss, Z. Z. Nagy, and Gy. T. Balogh, “Corneal-PAMPA: A novel, non-cell-based assay for prediction of corneal drug permeability,” Eur. J. Pharm. Sci., 128, 2019.